

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
التفاعل SN1 : الآلية والحركية. الخطوة المعينة للسرعة
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 203 - 6th ed
14-2-2017
1150
التفاعل SN1 : الآلية والحركية. الخطوة المعينة للسرعة
The SN1 reaction : mechanism and kinetics, Rate – determining slep
يتبع تفاعل بروميد ثالثي البوتيل وايون الهيدروكسيد الذي يعطي كحول ثالثي الوتيل، الحركية من المرتبة الأولى التي تتعلق السرعة فيها بتركيز احد المتفاعلات فقط والذي هو بروميد ثالثي البوتيل.

كيف تفسر ان السرعة مستقلة عن [OH-]؟ إذا كانت سرعة التفاعل غير متعلقة بــ [OH-] ، فإن هذا يعني، فقط ، ان التفاعل الذي نقيس سرعته، لا يتضمن (OH-).
تتوافق هذه الملاحظات ، تماماً، مع الآلية التالية ، بتفارق بروميد ثالثي البوتيل ببطء (الخطوة 1) إلى أيون بروميد وكاتيون مشتق من زمرة ثالثي البوتيل (كربوكاتيون). يرتبط هنا الأخير بسرعة، بعدئذ، مع أيون الهيدروكسيد معطياً كحول ثالثي البوتيل (الخطوة 2).
تعين السرعة الكلية لمجمل التفاعل بالكسر البطيء للرابطة C – Br مكوناً الكربوكاتيون الذي يتفاعل بمجرد تشكله معطياً المنتج.
ان السرعة التي نقيسها واقعياً ، هي سرعة الخطوة (1) ، وهذه الخطوة لا تتضمن (OH-) . "تسمى الخطوة الوحيدة التي تعين سرعتها السرعة الكلية لمجمل التفاعل، الخطوة المعينة لسرعة التفاعل".

ليس مدهشاً ان تتضمن الخطوة المعينة للسرعة هنا كسر رابطة، اي انها عملية تحتاج للطاقة. تعد هذا التحطم الخاص نموذجاً لتحلل لا متجانس، اي كسر يذهب فيه الالكترون الرابطان مع الشظية ذاتها ، انها عملية تتطلب حتى طاقة أكثر من التحلل المتجانس الذي صادفناه في الاستبدال الجذري.
وليس مدهشاً ، كذلك ، ان يكون ترابط الكربوكاتيون مع أيون الهيدروكسيد، خطوة سريعة جداً، لأنها تتضمن فقط، تكون رابطة أي إنها عملية محددة للطاقة . إننا نعد هذا الترابط تفاعل حمض – أساس حسب مفهوم "لويس".
نحن نعلم أن ايون الهيدروكسيد اساس قوي، وكما سنرى ، فإن الكربوكاتيونات حموض لويس قوية.
تدعى هذه الآية بالآلية SN1 (الاستبدال النوكليوفيلي احادي الجزيء).
يستخدم التعبير "أحادي الجزيء" هنا لأن الخطوة المعينة للسرعة تتضمن جزيئاً واحداً فقط (يغدو العديد من جزيئات المذيب الضرورية مهملاً).
يجب ألا يتصور ان قوانين الكيمياء ، قد عطلت ، بطريقة ما، بشكل سيجري من أجل الخطوة الثانية السريعة. إنها تشمل تفاعلاً مع (OH-) ، وتتعلق سرعتها بتركيز [OH-] والشيء الخاص هنا هو أنه حتى إذا خفضت سرعة الخطوة (2) بتخفيض [OH-] ، فإنها تبقى اسرع كثيراً من الخطوة (1) ، ولا يجوز أن يؤثر اي تغير في سرعتها على السرعة الكلية.
لنر ماذا نعني "بخطوة معينة للسرعة" في تفاعل كهذا، حيث R مركب متوسط فعال (كربوكانيون، جذر حر، كربانيون) يكون تركيزه مستقراً في حالة مستقرة منخفضة أثناء التفاعل.

ويكون التعبير الحركي الحقيقي لتكون المنتج هو:

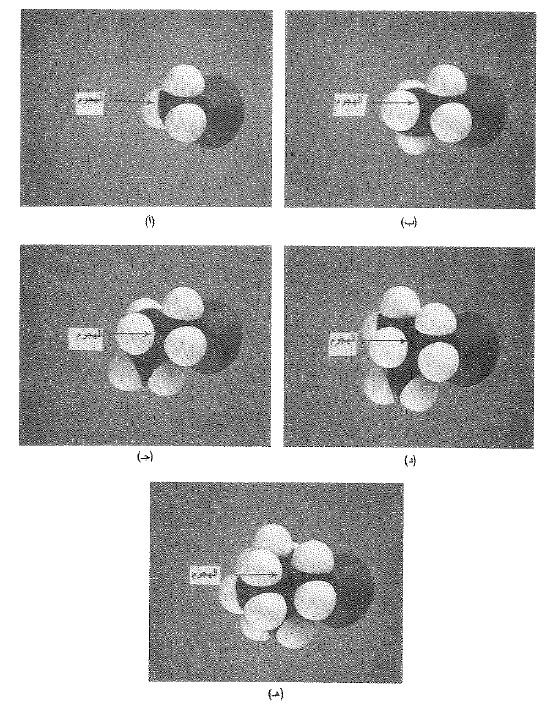
الشكل 1.1 البنية الجزيئية والتفاعلية : عامل الإعاقة الفراغية في تفاعل SN2 ، نماذج لبروميدات ألكيل : (أ) متيل، (ب) إتيل، (جـ) نظامي بروميل ، (د) ايزو بوتيل (هـ) نيوينتيل. بازدياد حجم المتبادل الوحيد على الكربون الحامل (-Br)، يزداد الازحام في نقطة هجوم النوكليوفيل .
لنرى ماذا تعين هذه العلاقة ، دون الولوج في طريقة اشتقاقها.
يوجد الحد [A] K1 في البسط ، والحد [C] K2 في مقام المقام ؛ وبمقدار ما يكون كبيرين ، بمقدار ما تكون السرعة كبيرة. وهذا أمر منطقي، لأن [A]K1 هي سرعة الخطوة (1) ، ويتعلق [C]K2 بسرعة الخطوة [B]K-1 في المقام ، وبمقدار ما يكون كبيراً بمقدار ما تتباطأ السرعة. إن هذا مفهوم أيضاً، طالما انه يتعلق بسرعة التفاعل المعاكس للخطوة (1).
والآن، إذا نصادف ان كان [C]K2 اكبر كثيراً من [C] K-1 فإن الحد [C]K2/[B]K-1 يكون صغيراً جداً بالنسبة للخطوة (1) وعندها يهمل. ونحصل في هذه الشروط على تعييرنا المألوف للسرعة، من اجل حركية من المرتبة الاولى.
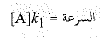
ولكن إذا كان …… اكبر كثيراً من ……. فإن هذا يعني ، أن الخطوة (2) اسرع كثيراً من التفاعل المعاكس للخطوة (1) . وهذا هو المتطلب الفعلي لتكون الخطوة (1) المعينة للسرعة . هل هذا يعني يعكس ما قبل آنفاً ألا تكون الخطوة (1) في الاتجاه المباشر الامام – أبطأ من الخطوة (2)؟ يجب ان تبقى الخطوة (1) ، الخطوة البطيئة ، وإلا فإن المركب المتوسط الفعال يتكون بسرعة اكبر مما يستهلك فيزداد تركيزه وهذا معاكس لطبيعة المركب المتوسط الفعال، ومخالف للشرط الذي وضعت معه العلاقة الحركية (3).
ما هي حقيقة ان تستطيع هاليدات الالكيل التفاعل وفق آلة SN1 ؟ فكما راينا للتو، تتوافق مع حركة من المرتبة الاولى، لتفاعل مثل الذي يحدث بين بروميد ثالثي اليوتيل وايون الهيوركسيد. وبشكل عام ، "يتبع تفاعل SN1 حركية من المرتبة الأولى" . وتعين السرعة الكلية للتفاعل بسرعة تأين هاليد الالكيل ، وعليه، فهي تتعلق ، فقط ، بتركيز هاليد الالكيك.