

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Weight/volume percentage
المؤلف:
John T. Moore, EdD
المصدر:
Chemistry Essentials For Dummies
الجزء والصفحة:
p 139
24-1-2017
2760
Weight/volume percentage
Weight/volume percentage is very similar to weight/weight percentage, but instead of using grams of solution in the denominator, it uses milliliters of solution:
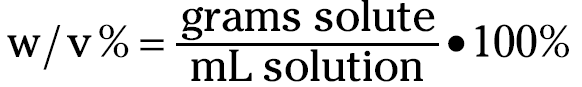
Suppose that you want to make 100 milliliters of a 15 percent (w/v) potassium nitrate solution. Because you’re making 100 milliliters, you already know that you’re going to weigh out 15 grams of potassium nitrate (commonly called saltpeter — KNO3).
Now, here comes something that’s a little different: You’re more concerned with the final volume of the solution than the amount of solvent you use. So you dissolve the 15 grams of KNO3 in a little bit of water and dilute it to exactly 100 milliliters in a volumetric flask. In other words, you dissolve and dilute 15 grams of KNO3 to 100 milliliters. You won’t know exactly how much water you put in, but it’s not important as long as the final volume is 100 milliliters.
You can also use the percentage and volume to calculate the grams of solute present. You may want to know how many grams of sodium hypochlorite are in 500 milliliters of a 5 percent (w/v) solution of household bleach. You can set up the problem like this:
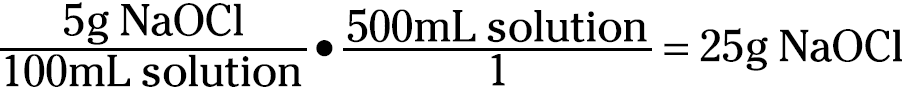
You now know that you have 25 grams of sodium hypochlorite in the 500 milliliters of solution.