

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
حركية التبادل النوكليوفيلي الأليفاتي. تفاعلات من المرتبة الثانية وتفاعلات من المرتبة الأولى.
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 193 - 6th ed
27-12-2016
711
حركية التبادل النوكليوفيلي الأليفاتي. تفاعلات من المرتبة الثانية وتفاعلات من المرتبة الأولى.
Kinetics of nucleophilic aliphatic substitution. Second-order reactions
لنأخذ مثالاً نوعياً، وليكن تفاعل بروميد المتيل مع هيدروكسيد الصوديوم الذي يعطي الميتانول:
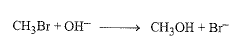
يمكن أن يجري التفاعل في محلول مائي للإيتانول، حيث تذوب فيه المتفاعلات.
إذا حدث التفاعل نتيجة تصادم بين شاردة الهيدروكسيد وجزيء بروميد المتيل، فعلينا ان نتوقع تعلق سرعته بتركيز كلا المتفاعلين. إذا ضوعف تركيز (OH-) والمعبر عنها [OH-] أو (CH3Br) والمعبر عنه [CH3Br] فإن تواتر التصادم يجب أن يتضاعف وبالتالي تتضاعف سرعة التفاعل إذا خفض تركيز أي من المتفاعلين الى النصف فيجب على توتر التصادم، وبالنتيجة السرعة، أن ينخفض الى النصف.
ولقد وجد أن الأمر كذلك. ونقول أن سرعة تفاعل تتعلق بتركيزي [OH-] و[CH3Br]، ويعبر عن هذا بالعلاقة الآتية:
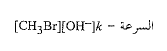
إذا عبر عن التراكيز بالمول في الليتر، عندئ تكون (k) العدد الذي إذا ضرب بهذه التراكيز فإنه يعطينا عدد مولات الميتانول المتكونة في ليتر كل ثانية. فمن أجل درجة حرارة محددة وفي محل معين تبقى قيمة (k) دون تغير وهي تميز هذا التفاعل دون سواه، ويسمى (k) (ثابت السرعة).
فمثلاً، من أجل التفاعل بين بروميد المتيل وأيون الهيدروكسيد في مزيج من 80% إيتانول و20% ماء وفي الدرجة 55˚س، تكون قيمة (k): (0.0214 ليتر/مول/ثانية). ليس ما رأيناه الآن مدهشاً بالطبع فنحن جميعاً نعلم أن زيادة التركيز تؤدي الى زيادة في السرعة. ولكن دعونا الآن نلتفت الى التفاعل بين بروميد ثالثي البوتيل وأيون الهيدروكسيد:
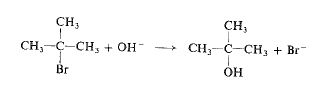
وكما سبق، إذا ضاعفنا [RBr] تتضاعف السرعة، وإذا خفضنا [RBr] الى النصف، تنخفض قيمة السرعة الى النصف أيضاً. ولكن إذا ضاعفنا [OH-] الى النصف، فإن السرعة لا تتغير. أي أن سرعة التفاعل مستقلة عن [OH-].
تتعلق سرعة التفاعل، فقط، بتركيز بروميد ثالثي البوتيل. ويعبر عن هذا بالعلاقة:
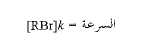
فمن أجل تفاعل بروميد ثالثي البوتيل في مزيج 80% كحول و20% ماء وفي الدرجة 55˚س تكون قيمة ثابت السرعة (0.01/ثانية). ويعني هذا أنه يتفاعل (0.010) من المول، من أجل كل مول من بروميد ثالثي بوتيل موجود في كل ثانية مهما يكون [OH-].
يقال أن تفاعل بروميد المتيل يتبع (حركية من المرتبة الثانية) لأن سرعته تتعلق بتركيزي المتفاعلين. ويقال أن تفاعل بروميد ثالثي البوتيل يتبع (حركية من المرتبة الأولى) لأن سرعته تتعلق بتركيز أحد المتفاعلين، فقط.