

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 107 - 6th ed
27-11-2016
2331
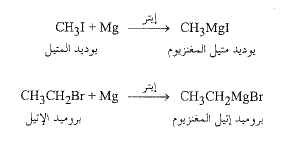
كاشف غرينيار: مركب عضوي معدني
The Grignard reagent: an organometallic compound
عندما يضاف، ببطء، محلول أحد هاليدات الألكيل في الإيتر الإتيلي الجاف (C2H5)2O، الى المغنزيوم المعدني، مع التحريك، فإن تفاعلاً عنيفاً يحدث: يغزو المحلول ضبابياً ويبدأ بالغليان، ويختفي معدن المغنزيوم بالتدريج. يسمى المحلول الناتج (كاشف غرينيار). تيمناً بفيكتور غرينيار (V.Grignard) من جامعة (ليون) الذي حاز على جائزة نوبل في العام (1912) على اكتشافه هذا. إنه أحد أكثر الكواشف، المعروفة في الكيمياء العضوية، تنوعاً وفائدة.
يملك كاشف غرينيار الصيغة العامة (RMgX)، وله تسمية عامة هي هاليد ألكيل المغنزيوم. إن الرابطة كربون – مغنزيوم تشاركية إلا أنها عالية القطبية لأن الكربون يسحب الألكترونات من المغنزيوم الكهرجابي، وتكون الرابطة مغنزيوم – هالوجين، أساساً، أيونية.
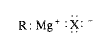
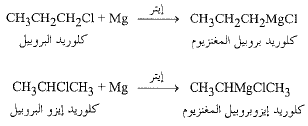
وبما أن المغنزيوم يصبح مرتبطاً مع الكربون الذي كان يحمل الهالوجين سابقاً، فإن زمرة الألكيل تبقى دون مساس أثناء عملية تحضير الكاشف. وهكذا يعطي كلوريد البروبيل كلوريد البروبيل كلوريد نظامي بروبيل المغنزيوم، ويعطى كلوريد إيزو البروبيل كلوريد إيزو بروبيل المغنزيوم.
يعد كاشف غرينيار أفضل كاشف معروف من صنف عريض من المركبات المسماة بالمركبات العضوية المعدنية حيث يرتبط فيها الكربون بمعدن مثل الليثيوم أو البوتاسيوم أو الصوديوم أو الزنك أو الزئبق أو الرصاص أو الثاليوم – وعموماً أي معدن معروف.
لكل نوع من المركبات العضوية المعدنية، بالطبع، صفاته الخاصة، وله كذلك استعمالاته المتعلقة بذلك. ولكن، مهما يكن المعدن، فإنه أقل كهرسلبية من الكربون، وتكون الرابطة كربون – معدن مثل التي في كاشف غرينيار – عالية القطبية ومع ذلك، ليست الزمر العضوية كربانيوناً بكل ما تعنيه كلمة كربانيون من معنى أي الأنيون الذي يحمل فيه الكربون شحنة سالبة ، ومع ذلك فإنه يمكن اعتبارها بصورة محسوسة لها خاصية الكربانيون.
وكما سنرى فإن المركبات العضوية المعدنية تمتاز بفائدة عظيمة تعود الى خاصة مشتركة فيما بينها وهي أنه يمكنها أن تعمل مصدراً لانتقال كربون مع إلكتروناته مباشرة.
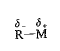
كاشف غرينيار مركب عالي الفعالية. فهو يتفاعل مع العديد منو المركبات اللاعضوية، بما فيها الماء وثنائي أكسيد الكربون والأكسجين ومع أغلب أنواع المركبات العضوية؛ ويوفر التفاعل، في كثير من هذه الحالات، السبيل الأفضل لصنع صنف خاص من المركبات العضوية.
إن التفاعل مع الماء لإعطاء ألكان، سلوك نوعي لكاشف غرينيار وللكثير من المركبات العضوية المعدنية الأكثر فعالية تجاه الحموض. وبالنظر لخاصية زمرة الألكيل، الكربانونية، يمكنا أن نعد كاشف غرينيار ملح مغنزيوم RMgX، للمحض الضعيف جداً R-H.
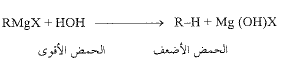
ويكون التفاعل، ببساطة، عبارة عن طرد الحمض الضعيف (R-H) من ملحه، بوساطة الحمض الأقوى (HOH).
وهكذا فإن الألكان عبارة عن حمض ضعيف يجري طرده من كاشف غرينيار بفعل مركبات يمكن النظر اليها عادة على أنها حموض ضعيفة جداً، أو يحتمل ألا تكون حموضاً البتة ويعد أي مركب يحوي هيدروجيناً مرتبطاً بأكسجين أو نترجين، أكثر حموضة الى درجة كبيرة جداً من الألكان، ولذلك فهو يستطيع تفكيك كاشف غرينيار، نذكر من هذه المركبات على سبيل المثال النشادر أو الكحول المتيلي.
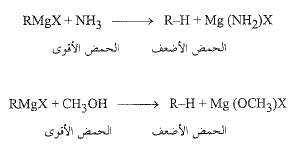
هناك حمض أفضل من آخر لتحضير الألكان، ولذلك نختار طبعاً أكثر الحموض توفراً وملاءمة وهو الماء.