

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
التفاعليات النسبية للهالوجينات مع الميثان
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 61 - 6th ed
8-11-2016
5007
التفاعليات النسبية للهالوجينات مع الميثان
Relative reactivities of halogens toward methane
لنعد بهذه الخلفية الى تفاعل الميثان مع مختلف الهالوجينات، علنا نستطيع اعتماد ترتيب التفاعلية المعطى سابقاً والذي هو F2>CI2>Br2>I2، وبشكل خاص حقيقة أن اليود لا يتفاعل البتة.
نستطيع من معرفة طاقات تفارق الروابط حساب AH لكل من الهالوجينات الأربعة، لكل خطوة من خطوات الهلجنة الثلاث. لما كانت (Eact) قد قيست، لبعض هذه التفاعلات فقط، دعونا نرى النتائج الممكنة التحقق باعتمادنا (AH) فقط.
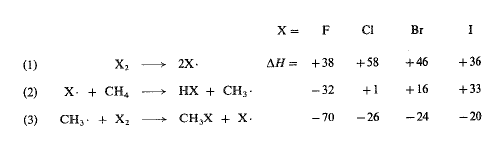
ولما كانت الخطوة (1) لا تشمل، ببساطة إلا تفارق الجزيئات الى ذرات، فإنه يمكننا أن نفترض أن (AH) تساوي، في هذه الحالة (Eact).
يملك الكلور أكبر طاقة تنشيط (Eact)، ولذلك يجب أن يتفارق أو ببطء أكبر؛ ويملك اليود أصغر طاقة تنشيط (Eact)، وعليه أ، يتفارق بالسرعة الأكبر. ولكن ذلك لا يتوافق مع ترتيب التفاعلية الملحوظ. وهكذا، ما عدا ربما بالنسبة للفلور، لا يمكن لتفارق الهالوجين الى ذرات أن تكون الخطوات التي تعين التفاعلية.
إن الخطوة (3) هجوم جذور المثيل على الهالوجين، وهي ناشرة للحرارة لكل الهالوجينات الأربعة، لها نفس القيمة تقريباً في الكلور، والبروم، واليود.
يمكن أن تكون (Eact) لهذه التفاعلات صغيرة جداً، هي فعلياً تبدو هكذا؛ إذ من المحتمل أن لا تزيد عن جزء من الكيلو حريرة. حتى اليود، فقد وجد أنه يتفاعل بسهولة مع جذور الألكيل المولدة بطريقة أخرى، مثلاً، بوساطة تسخين رباعي متل الرصاص. في الواقع، يستخدم، أحياناً، اليود كمصيدة للجذور الحرة أو قانص لها في دراسة آليات التفاعل.
ولذلك فإن الخطوة الثالثة لا يمكن أ، تسبب اختلافاً في التفاعلية النسبية المقيسة تجريبياً.
إن الخطوة الثانية (2) هي خطوة تجريد ذرة هيدروجين من الميثان بوساطة ذرة هالوجين – تصادف هنا قيم (AH) شديدة الاختلاف تتراوح بين تفاعل الفلور الشديد النشر للحرارة الى تفاعل ذرة اليود الشديد الامتصاص للحرارة.
يجب أن يكون لتفاعل ذرة البروم الماص للحرارة طاقة تنشيط تساوي 16 = Eact كيلو حريرة على الأقل؛ وكما رأينا، فإنها تساوي بالفعل 18 كيلو حريرة. يمكن لتفاعل ذرة الكلور الماص قليلاً للحرارة، أن يملك طاقة تنشيط (Eact) صغيرة جداً؛ إنها في الواقع 4 كيلو حريرة. فمن أجل درجة حرارة معطاة، إذن، تكون نسبة التصادمات ذات الطاقة الكامنة على الميثان مع الكلور، أكبر بكثير مما هي في تفاعل الميثان مع البروم. وبالتحديد، ففي درجة الحرارة (275˚س) يكون جزء التصادمات مساوياً نحو (1/40) في الكلور، في حين يكون مساوياً 1/15000000 في البروم.
تتصادم ذرة البروم، بالمتوسط، مع العديد من جزيئات الميثان قبل أن تنجح في الاستيلاء على ذرة هيدروجين؛ بينما تتصادم ذرة الكلور مع عدد أقل بكثير نسبياً وخلال بحثها الأطول عن جزيء ميثان مناسب، تبدو ذرة البروم أكثر احتمالاً بأن تواجه جسيماً نادراً آخر – ذرة بروم أخرى أو جذر مثيل – أو أن تقضي عليها جدران الوعاء. ولذلك تكون السلاسل أقصر مما هي في حالة الكلورة. وقد أظهرت التجارب أن الأمر كذلك: حيث يكون الطول الوسطى لسلسلة الكلورة مساوياً عدة آلاف؛ في حين هو أقل (100) مرة في البرومة. ورغم أن ذرات البروم تتولد بشكل أسرع من ذرات الكلور في درجة حرارة معينة بسبب القيمة الأقل لطاقة تنشيط الخطوة (1) فإن البرومة الاجمميكانيكية تكون أيضاً من الكلورة بسبب قصر طول السلسلة.
وفي حالة تفاعل ذرة اليود الماص للحرارة، مع الميثان لا تنقص قيمة Eact عن 33 كيلو حريرة، ومن المحتمل أن تكون أ:بر بقليل؛ وحتى من أجل هذه القيمة الصغرى 33 كيلو حريرة، يجب على ذرة اليود أن تتصادم مع عدد هائل من جزيئات الميثان (1013 أو عشرة مليون مليون في درجة الحرارة 275˚س) حتى يحدث التفاعل.
وفي النهاية، لا توجد ذرات يود قادرة على الاستمرار أكثر، بل تعود وتترابط مع بعضها البعض مشكلة جزيئات يود؛ وهكذا يحدث التفاعل بسرعة مهملة. تتولد ذرات اليود بسهولة، إلا أن عدم مقدرتها على الاستيلاء على هيدروجين من الميثان، هي التي تمنع حدوث اليوددة.
لا تستطيع التنبؤ بطاقة التنشيط (Eact) للهجوم الشديد النشر للحرارة الذي تقوم به ذرات الفلور على الميثان، لكن يجب، بالتأكيد، ألا نتوقعها أن تكون أ:بر من تلك الموافقة لهجوم ذرات الكلور على الميثان. في الواقع فإنها تبدو أصغر (نحو 1 كيلو حريرة)، وهذا الأمر الذي يسمح بالحصول على سلاسل أطول. وبسبب ضعف الرابطة فلور – فلور المدهش، فإن ذرات الفلور يجب أن تشكل أسرع من ذرات الكلور؛ تل وعدد أكبر من السلاسل أيضاً إن التفاعل الاجمالي ناشر للحرارة بشدة له AH مساوية – 102 كيلو حريرة. وتكون صعوبة تصريف هذه الحرارة أحد أسباب عدم إمكان التحكم بالفلورة.
وهكذا تكون، من بين خطوتي الانتشار، الخطوة (2) أكثر صعوبة من الخطوة (3) (انظر الشكل 1.1). تتفاعل جذور المثيل حال تشكلها بسهولة مع أي من الهالوجينات وتكون سرعة تشكل جذور المثيل هي المحددة للسرعة الكلية للتفاعل. وتكون الفلورة سريعة لأن ذرات الفلورة تستطيع الاستيلاء على ذرات الهيدروجين، بسرعة من الميثان؛ 1 – Eact كيلو حريرة فقط. ولا تحدث اليوددة لأن ذرات اليود غير قادرة، بالفعل على الاستيلاء على هيدروجين من الميثان حيث أن (Eact) أكبر من 33 كيلو حريرة.

الشكل 1.1: تغيرات الطاقة الكاملة مع تقدم التفاعل: كلورة الميثان. تشكل الجذر هي الخطوة الصعبة
نلاحظ أن قيم (Eact)، للخطوة (2)، توازي قيم (AH). ولما كانت نفس الرابطة، CH3-H، هي التي تتحطم في كل حالة، فإن الفروق في (AH) تعكس الفروق في طاقة تفارق مختلف الروابط هيدروجين – هالوجين.
وأخيراً، يبدو أن تفاعلية الهالوجين تجاه الميثان، تتعلق بقوة الرابطة التي يشكلها الهالوجين مع الهيدروجين.
وهناك قضية أخرى تحتاج الى التوضيح، فلقد قلنا أن (Eact) من رتبة (33 كيلو حريرة) كبيرة جداً ليحدث تفاعل ذرات اليود مع الميثان، بسرعة ملموسة، ومع ذلك تحتاج الخطوة الأولية في كل تفاعل من تفاعلات الهلجنة هذه، مقداراً من Eact أكبر.
والاختلاف نظراً لأن الهلجنة تفاعل متسلسل، فإن تفارق كل جزيء هالوجين يؤدي، أخيراً، الى العديد من جزيئات هالوجين المثيل؛ وهكذا، فعلى الرغم من أن التفارق بطيء جداً، فإن التفاعل الاجمالي يكون سريعاً.
إن هجوم ذرات اليود على الميثان، مع ذلك، هو انتشار السلسلة، فإذا كانت هذه الخطوة بطيئة كان التفاعل الاجمالي بطيئاً، وتحت تأثير هذه الظروف فإن خطوات انتهاء السلسلة (أي اتحاد ذرتي يود) تصبح مهمة جداً بحيث لا يكون هنالك، عملياً سلسلة على الاطلاق.