

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
السرع النسبية للتفاعلات Relative rates of reactions
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 60 - 6th ed
8-11-2016
1844
السرع النسبية للتفاعلات Relative rates of reactions
لقد رأينا أنه يمكن التعبير عن سرعة التفاعل بجذاء ثلاثة عوامل:
السرعة – تواتر التصادم × عامل الطاقة × عامل الاتحمال
يمكن أن يجري تفاعلان بسرعتين مختلفتين بسبب الاختلاف في أي من العوامل الثلاثة أو في جميعها. وللأخذ بالحسبان الاختلاف في السرعة، فإنه علينا، أولاً، أن نرى على أي من هذه العوامل يقع الاختلاف.
وكمثال، لنقارن تفاعلية ذرتي الكلور والبروم تجاه الميثان؛ أي لنقارن سرعتي التفاعلين في نفس الشروط:
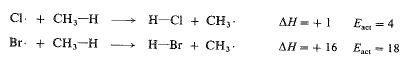
وطالما أن درجة الحرارة والتركيز، هما ذاتهما في التفاعلين، إذا كنا نقارنهما في نفس تأثيرات هاتين الخاصتين تميل الى اقناء بعضها وفي الواقع تختلف تواترات التصادم ببضع نسب مئوية فقط وكذلك نجد بصورة عامة أن تفاعلات متقاربين بصورة وثيقة ويحدثان في نفس درجة الحرارة ونفس التركيز، لا يختلفان إلا قليلاً في تواتر التصادم. ولذلك فإن الاختلاف في تواتر التصادم، لا يمكن أن يكون السبب في الاختلاف الكبير في التفاعلية.
فهمت طبيعة عامل الاحتمال بصورة سيئة. فطالما أن تفاعلينا متشابهان جداً لذلك يجب أن نتوقع عاملا احتمال متشابهان. لقد أظهرت التجارب ان هذا الأمر حقيقي: ففي كلا ذرتي، الكلور أو بروم، هنالك تصادم واحد من أصل كل من ثمانية تصادمات مع الميثان، يكون موجهاً بشكل مناسب لحدوث التفاعل.
وبصورة عامة، عند دراسة تفاعلات وثيقة الصلة يمكن أن نفترض أن اختلاف عامل الاحتمال، ليس هو السبب في الاختلاف الكبير في التفاعلية.
بقي علينا دراسة عامل الطاقة. ففي درجة حرارة معطاة، فإن التصادمات التي تملك كمية الطاقة اللازمة لحدوث التفاعل، تتعلق بمقدار ضخامة تلك الكمية، أي تتعلق بطاقة التنشيط (Eact). ففي مثالنا، تبلغ طاقة التنشيط لتفاعل الكلور 4 – Eact كيلو حريرة، ولتفاعل البروم 18 – Eact كيلو حريرة. وكما رأينا، فإن اختلافاً بهذا المقدار في طاقة التنشيط (Ecat)، بسبب اختلافاً هائلاً في عامل الطاقة، وبالتالي في السرعة ففي الدرجة (275˚س)، من أصل 15 مليون تصادم هنالك (375000) تصادم يملك طاقة كافية عندما يعني الأمر ذرات الكلور،، وهنالك تصادم واحد فقط يملك طاقة كافية عندما يعني الأمر ذرات البروم. فسبب الفرق في طاقة التنشيط، وحدها تكون ذرات الكلور أكثر تفاعلية بـ 375000 من ذرات البروم مع الميثان.
وكما شددنا، مراراً وتكراراً، فإن الفروقات في التفاعلية، يجب أن تعزى، فيا لحقيقة، الى الفروقات في (Eact) على أساس الاختلاف في البنية الجزيئية، ويجب أن يكون مفهوماً أن تبريرنا لفعل ذلك هو أن التفاعلات المقارنة، وثيقة الصلة بحيث تكون الفروقات في تواتر التصادمات وفي عامل الاحتمال، غير ذات معنى.