

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تقدم التفاعل : تغيرات الطاقة Progress of reaction: energy changes
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 51 - 6th ed
8-11-2016
3750
تقدم التفاعل : تغيرات الطاقة Progress of reaction: energy changes
يمكن رؤية العلاقات الطاقية هذه بشكل أوضح، على مخططات مثل المعطاة في الشكل 1.1 والشكل 2.1.
يمثل تقدم التفاعل بالاتجاه الأفقي، بدءاً من التفاعلات يساراً وحتى المنتجات الى يمين المنحنى. يدل ارتفاع منحنى الطاقة الكامنة (كامل الطاقة باستثناء الطاقة الحركية) على أي مرحلة من مراحل التفاعل.
دعنا نتبع مسار التفاعل في الشكل 1.1. نبدأ بمنخفض للطاقة الكامنة لجزيء الميثان وذرة الكلور. تتحرك هذه الجسيمات، ولذا تمتلك طاقة حركية بالإضافة الى الطاقة الكامنة المبينة. يتغير مقدار الطاقة الحركية باختلاف زوجي الجسيمات المحدد إذ أن بعضها يتحرك أسرع من الآخر. ثم يتصادمان وتتحول الطاقة الحركية الى طاقة كامنة. وبازدياد الطاقة الكامنة يبدأ التفاعل، ونتسلق هضبة الطاقة. إذ تحول من الطاقة الحركية ما يكفي، فإننا نصل القمية (قمة الهضبة ونبدأ بالهبوط من الطرف الآخر.
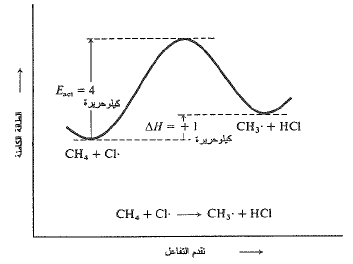
الشكل 1.1: تغيرات الطاقة الكامنة مع تقدم التفاعل: تفاعل الميثان – ذرة كلور
خلال الهبوط، تتحول الطاقة الكامنة الى طاقة حركية، حتى نصل الى مستوى المنتجات. تملك، هنا، المنتجات كمية من الطاقة أكبر قليلاً مما كانت تمتلك المتفاعلات، ونجد أنفسنا في منخفض للطاقة أعلى بقليل من المنخفض الذي بدأنا منه. مع هذه الزيادة في الطاقة الكامنة يجب أن يكون هناك تناقص موافق، في الطاقة الحركية تتحرك الجسيمات الجديدة كل على حده، ولما كانت هذه الجسيمات تتحرك ببطء أكثر من الجسيمات التي تشكلت منها، يحدث هبوط في درجة الحرارة وتمتص الحرارة من المحيط. في تفاعل البروم، المبين في الشكل (2.1)، نتسلق هضبة أعلى بكثير وتنتهي الى منخفض أكثر ارتفاعاً. إن التزايد في الطاقة الكامنة – والتناقص الموافق في الطاقة الحركية – أكبر بكثير مما هو عليه في تفاعل الكلور؛ ويجب امتصاص حرارة أكثر من المحيط.

الشكل 2.1: تغيرات الطاقة الكامنة مع تقدم التفاعل: تفاعل الميثان – ذرة بروم
يتبع التفاعل الناشر للحرارة نفس المسار. (خذ، على سبيل المثال، معكوس تفاعل البروم؛ الذي يُقرأ من اليمين الى اليسار في الشكل 2.1). في هذه الحالة تملك المنتجات طاقة كامنة أقل من تلك التي تملكها المتفاعلات.
وهكذا نصل الى نهاية صغرى منخفضة أكثر من تلك التي غادرناها. وهنا نجد أن الجسيمات الجديدة تملك طاقة حركية أكبر من تلك التي تملكها الجسيمات التي تشكلت منها وعليه فهي تتحرك أسرع، ونلاحظ ارتفاعاً في درجة الحرارة وتنتشر الحرارة الى المحيط.
يوجد في أي تفاعل العديد من التصادمات التي تقدم، قليلاً جداً من الطاقة اللازمة كي نصل الى قمة الهضبة. تكون هذه التصادمات غير مثمرة، ونعود أدراجنا الى وادي الانطلاق.
تقدم العديد من التصادمات طاقة كافية، لكنها تحدث عندما تكون الجزيئات موجهة بشكل غير مناسب. تتسلق، عندئذ، هضبة الطاقة، لكننا نكون في الطريق؛ ويمكن أن نتسلق حتى ارتفاع عالٍ جداً دون أن نجد الممر المؤدي الى الوادي التالي.
إن الفرق في المستوى بين الواديين، بالطبع، هو (AH)؛ وإن الفرق في المستوى بين المتفاعلات وقمة الهضبة هو (Eact). نحن معنيون، فقط، بهذه الفروق، ليس بالارتفاع المطلق في أي مرحلة من التفاعل. حتى إننا لسنا معنيين، حتى بالمستويات بالنسبة للمتفاعلات، في تفاعلي الكلور والبروم. إننا نحتاج الى معرفة أن في تفاعل الكلور، نتسلق هضبة بارتفاع (4 كيلو حريرة/مول)، ونصل الى وادٍ ذي طاقة أعلى بمقدار (1 كيلو حريرة) من نقطة الانطلاق؛ وهكذا، ففي تفاعل البروم نتسلق هضبة ارتفاعها (18 كيلو حريرة) وتصل الى وادي ارتفاعه (16 كيلو حريرة) بالمقارنة مع نقطة الانطلاق.
وكما سنرى، فإن ارتفاع الهضبة (Eact) هو الذي يحدد سرعة التفاعل، وليس الفرق بين مستوى الواديين، AH. وبالانتقال الى وادٍ أخفض، قد تكون الهضبة عميكانيكية جداً، وقد تكون منخفضة جداً أو حتى غير موجودة. وبالانتقال الى وادٍ أعلى فلا يمكن أن تكون الهضبة أخفض من الوادي المقصود، وهذا يعني أنه في تفاعل ماص للحرارة يجب أن تكون (Eact) على الأقل من رتبة (AH).
إن مخطط طاقة، كالذي رأيناه في الشكلين 1.1 و 2.1 مفيد، بشكل خاص، لأنه يخبرنا عن التفاعل المدروس فحسب، بل وعن التفاعل المعاكس له أيضاً.
لتتحرك من اليمين الى اليسار في الشكل (1.1) مثلاً. نجد أن التفاعل يملك طاقة تنشيط تساوي (3 كيلو حريرة)،
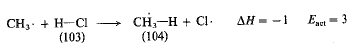
طالما أننا نتسلق الهضبة من الوادي الأعلى في هذه الحالة. لذلك فهو تفاعل ناشر للحرارة، 1- = AH كيلو حريرة.
وبنفس الأسلوب يمكن أن نرى من الشكل 2.1 أن التفاعل يملك طاقة تنشيط تساوي (2 كيلو حريرة)، وأنه ناشر للحرارة (16 – AH كيلو حريرة). (نلاحظ أنه، حتى رغم أن هذين التفاعلين ناشران للحرارة، فإنهما يملكان طاقة تنشيط).
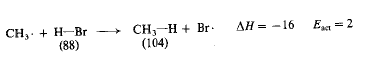
إن تفاعلاً مثل شطر جزيء الكلور الى ذرتين، يقع ضمن مجموعة خاصة:
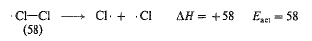
تتحطم هنا رابطة ولا تتشكل روابط جديدة. يكون التفاعل العكسي هو اتحاد ذرتي كلور لا يشمل كسر روابط وبالتالي، فإنه يتوقع أن يحدث بسهولة كبيرة – في الواقع، دون طاقة تنشيط البتة.
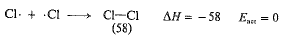
ولقد عد هذا الأمر، بشكل عام، صحيحاً في التفاعلات التي تتضمن اتحاد زوجين من الجذور الحرة. إذ لا يوجد هضبة نتسلقها لدى الانتقال من ذرتي كلور الى جزيء كلور، بل ببساطة هناك ميل انحداري، يجب أن يتضمن شطر جزيء كلور، ببساطة، صعوداً مائلاً، كما هو مبين في الشكل (3.1). وهكذا، فإن طاقة تنشيط (Eact) تحطم جزيء الكلور؛ ويجب أن تساوي (AH) (58 كيلو حريرة). يعتقد، بشكل عام، أن هذه المساواة بين (Eact) و (AH) قائمة في التفاعلات التي تتفكك فيها الجزيئات الى جذور حرة.
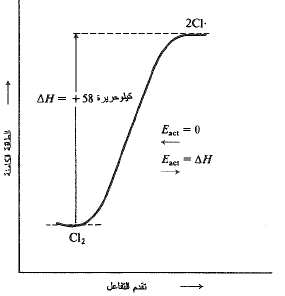
الشكل 3.1: تغيرات الطاقة الكامنة أثناء تقدم التفاعل: تفارق بسيط