

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
بنية الميثان Structure of methane
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 42 - 6th ed
7-11-2016
2600
بنية الميثان Structure of methane
إن كل ذرة من ذرات الهيدروجين الأربع ترتبط بذرة الكربون بروابط تشاركية، أي بالتشارك بشفع من الالكترونات. عندما يرتبط الكربون بأربع ذرات أخرى، فإن مداراته الرابطة (المدارات sp3) المتشكلة من مزج مدار واحد من نوع (s) مع ثلاثة مدارات من نوع (p) تتوجه نحو زوايا رباعي وجوه (الشكل 1.1آ). إن هذا الترتيب رباعي الوجوه هو الترتيب الوحيد الذي يسمح للمدارات بالتباعد الى أقصى حد ممكن. ولكي يتراكب كل من هذه المدارات بفاعلية أكبر، مع المدار s الكروي لذرة هيدروجين، وبالتالي لكي تتشكل رابطة أقوى، فإن على كل ذرة هيدروجين أن تتوضع عند أحد رؤوس رباعي الوجوه (الشكل 1.1 ب).
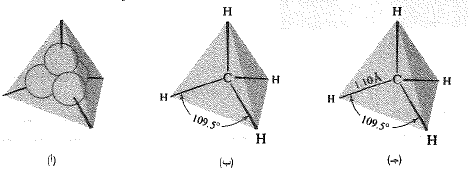
تشكل 1.1: جزيء الميثان: (آ) المدارات sp3 رباعية الوجوه، (ب) الشكل المتوقع. تتوضع نوى H تتوافق مع تراكب أعظمي، (جـ) الهيئة والمقاس.
لقد اختبرت البنية الرباعية الوجوه للميثان بواسطة طريقة الانعراج الالكتروني (electron diffraction)، (الشكل 1.1 جـ)، التي تبين دون أدنى شك ترتيب الذرات في جزيئات بسيطة كهذه.
سنفحص فيما بعد بعض الدلائل التي قادت الكيميائيين الى قبول البنية الرباعية الوجوه هذه قبل وقت طويل من معرفة ميكانيك الكم، والانعراج الالكتروني.
سنكتب صيغة الميثان بشكل عادي باستخدام الخط المستقيم لتمثيل كل شفع من الالكترونات يشترك بهما الكربون والهيدروجين (I). ولتركيز الانتباه على الالكترونات الفردية فقد يشير أحياناً الى شفع الالكترونات بنقطتين (II) وأخيراً، عندما نرغب في تمثيل الشكل الحقيقي للجزيء سنستخدم الصيغة ثلاثية الأبعاد البسيطة مثل (III) أو (IV).

في الصيغ ثلاثية الأبعاد التي من هذا النوع، يمثل الخط الثخين المتواصل الذي هو على شكل اسفين رابطة تتجه نحونا خارجة من مستوى الورقة، ويمثل الاسفين المتقطع، رابطة تبتعد عنا خلف مستوي الورقة ويمثل الخط العادي رابطة متوضعة في مستوى الورقة. تمثل صيغ مثل (III) و(IV) الميثان كما في الشكلين 2.1أ و2.1ب، بالترتيب.

الشكل 2.1: نماذج لجزيء الميثان موجهة بطرق مختلفة