

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الحموض والقواعد Acids and bases
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 33 - 6th ed
1-11-2016
7183
الحموض والقواعد Acids and bases
لنقم قبل أن تتحول من الخواص الفيزيائية الى الخواص الكيميائية، بمراجعة موجزة لأحد المواضيع المألوفة والقاعدية لفهم الكيمياء العضوية: أي موضوع (الحموضة والقاعدية).
قد عرف، الحمض والقاعدة، بطرق متعددة، يوافق كل منها طريقة خاصة في النظر الى الخواص الحمضية والقاعدية. وسنحد من المفيد النظر الى الحموض والقواعد وفق وجهتي نظر فقط منها؛ تتعلق إحداها، التي اخترناها، بالمسألة التي نقوم بدراستها.
طبقاً لتعريف لوري – برونستد (Lowry – Bronsted)، فإن الحمض هو مادة تتخلى عن بروتون، وأن القاعدة هو مادة تتقبل بروتوناً. فعندما ينحل حمض الكبريت في الماء يتخلى الحمض H2SO4 عن بروتون (نواة هيدروجين) إلى القاعدة H2O مشكلاً الحمض الحديد (H3O+) والقاعدة الحديد (HSO4-). وعندما يتفاعل كلوريد الهيدروجين مع الأمونيا، فإن الحمض (HCI) يتخلى عن البروتون للقاعدة (NH3) مشكلاً الحمض الحديد (NH4+) والقاعدة الحديد (CI-).

وطبقاً لتعريف لوري – برونستد، فإن قوة الحمض تتعلق بميله لإعطاء البروتونات (منح البروتونات)، وكذلك كون قوة القاعدة متعلقة بميله لقبول البروتونات. إن حمض الكبريت وكلوريد الهيدروجين، حمضان قويان، لأنهما يميلان للتخلي عن البروتونات بسهولة؛ وبالعكس، فإن أيونات الكبريتات الهيدروجينية (HSO4-)، وأيون الكبلوريد (CI-) قاعدةان ضعيفان لأنهما يملكان ميلاً ضعيفاً لقبول البروتونات. وفي جميع التفاعلات التي ذكرناها، يميل التوازن باتجاه تشكيل الحمض الأضعف والقاعدة الأضعف. وعند مزج (H2SO4) المائي مع (NaOH) المائي، فإن الحمض (H3O+) (أيون الهيدرونيوم) يتخلى عن بروتون للقاعدة (OH-) مشكلاً الحمض الحديد (H2O)، والقاعدة الحديد المائي (H2O). وعندما يمزج (NH4CI) المائي مع (NaOH) المائي، فإن الحمض (NH4+) (أيون الأمونيوم)، يتخلى عن بروتون للقاعدة (OH-) مشكلاً الحمض الجديد (H2O) والقاعدة الجديد (NH3).

ففي كلتا الحالتين تقبل القاعدة القوي (OH-) بروتوناً ليشكل الحمض الضعيف (H2O). وإذا رتبنا هذه الحموض وفق التسلسل المذكور، فإن علينا بالضرورة أن نرتب القواعد الموافقة (المترافقة) وفق تسلسل معاكس.
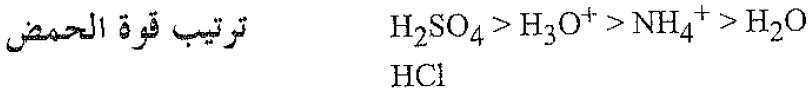
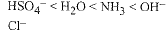 ترتيب قوة القاعدية
ترتيب قوة القاعدية