

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
قطبية الروابط Polarity of bonds
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 23 - 6th ed
1-11-2016
2869
قطبية الروابط Polarity of bonds
بالإضافة الى الخواص الموصوفة سابقاً، فإن لبعض الروابط المشتركة خاصية أخرى، هي القطبية. نعلم أنه إذا ارتبطت ذرتان برابطة مشتركة فإنهما تتشاركان بالالكترونات، وأن نواتيهما متثبتتان بذات السحابة الالكترونية. لكن، في أغلب الأحيان، لا تتشارك النواتان بالالكترونات بالتساوي، فتكون السحابة الالكترونية اكثف حول إحدى النواتين مما هي عليه حول النواة الأخرى. وهكذا يغدو أحد طرفي الرابطة سلبياً نسبياً والطرف الآخر إيجابياً نسبياً وهكذا يكون هناك قطب سالب وقطب موجب. تدعى مثل هذه الرابطة، رابطة قطبية، أو أنها تملك صفات قطبية.
يمكن أن ندل على القطبية باستخدام الرمزين +δ و -δ ، اللذين يدلان على شحنات جزئية موجبة وسالبة على الترتيب. (تقول (دلتا موجبة) و (دلتا سالبة)). كما في المثال التالي:
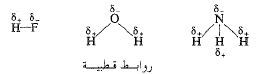
يمكننا معرفة هل الرابطة المشتركة تملك صفات قطبية، وذلك بمعرفة هل تجمع ذرتين تختلفان بميلهما لجذب الالكترونات، أي إذا كانت الذرتان مختلفتين بالكهرسلبية electronegativity. زد على ذلك، أنه كلما كان الفرق بالكهرسلبية أكبر، كلما كانت قطبية الرابطة أكبر.
تتوضع العناصر ذات الكهرسلبية الأكبر في الزاوية اليمينية العليا من الجدول الدوري. ومن بين العناصر التي سنصادفها في الكيمياء العضوية، فإن الفلور هو الأكثر كهرسلبية، يليه الاكسجين ومن ثم النتروجين والكلور ثم البروم، وأخيراً الكربون. ولا يختلف الهيدروجين عن الكربون، كثيراً، بصفته الكهرسلبية، ولسنا على يقين هل الهيدروجين أكثر أم أقل كهرسلبية من الكربون.
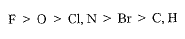 الكهرسلبية
الكهرسلبية
إن قطبية الروابط مسؤولة، حقيقة، عن الخواص الفيزيائية والكيمياوية للمركب. ويمكن أن تؤدي قطبية الروابط الى قطبية الجزيء، وبالتالي الى تأثير كبير في نقطة الانصهار، ونقطة الغليان، والذوبان. تعين قطبية الرابطة نوع التفاعلات الممكنة الحدوث على تلك الرابطة، وحتى يمكن أن تعين التأثير في فاعلية الروابط المجاورة.