

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
المدارات الهجينة: Hybrid orbitals: sp sp
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 11 - 6th ed
31-10-2016
5855
المدارات الهجينة: Hybrid orbitals: sp sp
لندرس جزيء كلوريد البريليوم، BeCl2
لا يملك البريليوم إلكترونات مفردة (غير متزاوجة)، (الجدول 1.1)، فكيف يمكننا تفسير ترابطه مع ذرتي كلور. إن تشكل الرابطة هو عملية تحرر الطاقة (عملية تقود الى الاستقرار)، وإن الميل هو نحو تشكيل الروابط) – أكبر عدد ممكن منها – حتى ولو نتجت عن ذلك مدارات رابطة تحمل القليل من الشبه للمدارات الذرية التي تكلمنا عنها. إذا كانت طريقتنا الذهنية في بناء الجزيئات قابلة للتطبيق هنا، فإنها يجب أن تعدل. يجب علينا اختراق نوع تخيلي من ذرات البريليوم، نوع أقرب ما يكون الى الارتباط مع ذرتي كلور.

للوصول الى ذرة البريليوم الثنائية التكافؤ هذه، يجب أن نقوم ببعض التخمينات الالكترونية. أولاً لنرفع أحد الالكترونات 2s الى مدار 2p فارغ:
رفع الكترون واحد أصبح لدينا الكترونان غير متزاوجين
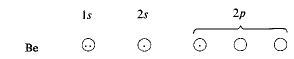
يوفر ذلك الكترونين غير متزاوجين لازمين للارتباط مع ذرتي كلور. الآن، علينا أن نتوقع أن يشكل البريليوم رابطة من نوع ما مستعملاً المدار p ورابطة من نوع آخر، مستخدماً المدار s. ولكن ذلك يخالف الحقيقة التي تبين أن رابطتي كلوريد البريليوم متكافئتان تماماً.
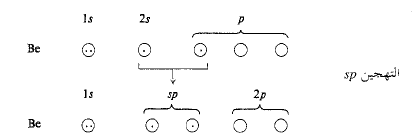
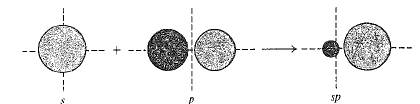
لنقم الآن بتهجين المدارات. تؤخذ مختلف الامكانات الرياضية لاجتماع مدار واحد s مع مدار واحد p، ونجد الدارات المختلطة (الهجينة) التي لها أعلى درجة من الصفة التوجيهية (الشكل 1.1).
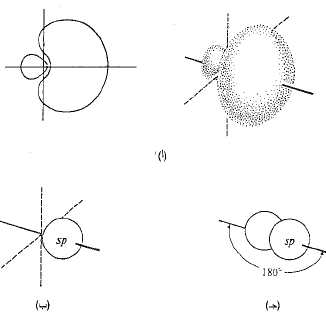
الشكل 1.1: مدارات ذرية: مدارات هجينة sp. (أ) المقطع العرضي والشكل التقريبي لمدار مفرد متوجه بقوة وفق أحد المحاور. (ب) تمثيل بشكل كرة. حذف الانتفاخ الخلفي الصغير. (جـ) مداران محوراهما متوضعان وفق خط مستقيم.
فكلما كان المدار الذري أكثر تركيزاً في أنحاء الرابطة كان التراكب أكبر، والرابطة أقوى. تنبثق عن الحسابات ثلاث نتائج مهمة جداً هي: (أ) إن المدار الجين الأفضل وهو الأكثر توجهاً من أي من المدارين s أو p؛ (ب) إن أفضل مدارين يكونان متكافئين تماماً؛ (جـ) يتجه هذان المداران وفق اتجاهين متعاكسين تماماً، الأمر الذي يسمح لهما بالابتعاد عن بعضهما بأكبر قدر ممكن (تذكر مبدأ الاستبعاد لباولي). وهكذا تكون الزاوية بين المدارين مساوية 180˚. تدعى هذه المدارات الهجينة الخاصة، المدارات sp، لأنها تنشأ من مزج مدار واحد s مع مدار واحد p. ويكون لهذه المدارات الهيئة الموضحة في (الشكل 5.1أ). وللسهولة سوف نهمل الانتفاخ الخلفي الصغير، ونمثل الانتفاخ الأمامي على شكل كرة. لنستخدم البيريليوم ذي التهجين sp هذا في بناء كلوريد البيريليوم. ينكشف هنا مفهوم مهم للغاية، هو زاوية الرابطة. ولكي يحدث تراكب أعظمي بين مداري البريليوم sp ومداري ذرتي الكلور؛ يجب أن تتوضع نواتا الكلور على امتداد محوري المدارين sp، أي يجب أن تتوضعا، في جهتين متعاكستين تماماً من ذرة البريليوم (الشكل 1.1). ولذلك، يجب أن تكون الزاوية بين الرابطتين بريليوم – كلور 180˚.
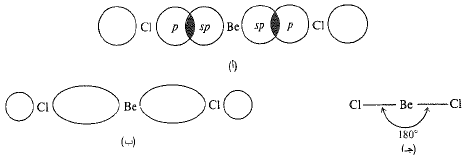
الشكل 1.1 : تشكل رابطة في جزيء BeCl2: (أ) تراكب مدارات sp مع مدار p. (ب) مدارات الرابطة a. (جـ) هيئة الجزيء.
بينت التجارب، وكذلك الحسابات، أن جزيء كلوريد البريليوم خطي، أي أن الذرات الثلاث تقع على استقامة واحدة.
لا شيء سيجدي فيما يتعلق بازدياد الصفات التوجيهية المواكبة لعملية التهجين، يكون الانتفاخان التابعان للمدار p من طورين متعاكسين يؤدي الاتحاد مع مدار s الى إضافة في احدى جهتي النواة وطرح في الجهة الأخرى.
وإذا كنت فضولياً بشان الطور وتأثيره في الربط اقرأ الفقرات 1.28 – 4.28 التي يمكنك فهمها بعد أن تجاوزت هذه المرحلة.