
Selection rules
 المؤلف:
CATHERINE E. HOUSECROFT AND ALAN G. SHARPE
المؤلف:
CATHERINE E. HOUSECROFT AND ALAN G. SHARPE
 المصدر:
INORGANIC CHEMISTRY
المصدر:
INORGANIC CHEMISTRY
 الجزء والصفحة:
2th ed p 571
الجزء والصفحة:
2th ed p 571
 23-8-2016
23-8-2016
 1351
1351
Selection rules
Electronic transitions obey the following selection rules. Spin selection rule: ΔS = 0 Transitions may occur from singlet to singlet, or triplet to triplet states and so on, but a change in spin multiplicity is forbidden. Laporte selection rule: There must be a change in parity: allowed transitions: g ↔ u forbidden transitions:
g↔g u↔ u
This leads to the selection rule: Δl = _1 and, thus, allowed transitions are s →p, p → d, d → f ; forbidden transitions are s → s, p → p, d → d, f → f , s → d, p → f etc. Since these selection rules must be strictly obeyed, why do many d-block metal complexes exhibit ‘d–d’ bands in their electronic spectra?
A spin-forbidden transition becomes ‘allowed’ if, for example, a singlet state mixes to some extent with a triplet state. This is possible by spin–orbit coupling but for first row metals, the degree of mixing is small and so bands associated with ‘spin-forbidden’ transitions are very weak (Table 1.1).
Table 1.1 Typical Ԑmax values for electronic absorptions; a large Ԑmax corresponds to an intense absorption and, if the absorption is in the visible region, a highly coloured complex.
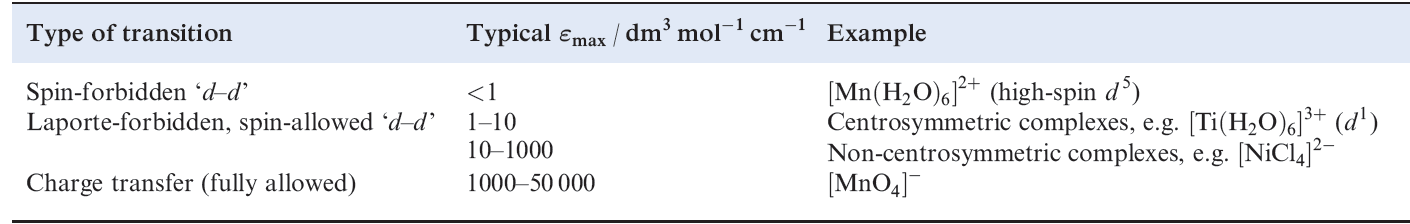
Spin-allowed ‘d–d’ transitions remain Laporte-forbidden and their observation is explained by a mechanism called ‘vibronic coupling’. An octahedral complex possesses a centre of symmetry, but molecular vibrations result in its temporary loss. At an instant when the molecule does not possess a centre of symmetry, mixing
of d and p orbitals can occur. Since the lifetime of the vibration (≈10-13 s) is longer than that of an electronic transition (≈10-18 s), a ‘d–d’ transition involving an orbital of mixed pd character can occur although the absorption is still relatively weak (Table 1.1). In a molecule which is noncentrosymmetric (e.g. tetrahedral), p–d mixing can occur to a greater extent and so the probability of ‘d–d’ transitions is greater than in a centrosymmetric complex. This leads to tetrahedral complexes being more intensely coloured than octahedral complexes.
 الاكثر قراءة في كيمياء العناصر الانتقالية ومركباتها المعقدة
الاكثر قراءة في كيمياء العناصر الانتقالية ومركباتها المعقدة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


