

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تأثير الرقم الهيدروجيني للمحيط
المؤلف:
أ.د.محمد مجدي عبد الله واصل
المصدر:
أسس الكيمياء الصناعية
الجزء والصفحة:
195-197
2025-02-06
204
إن تركيز أيون الهيدروجين فى الوسط المسبب للتأكل هو عامل مهم في عملية التآكل. فتآكل المعادن النشطة بواسطة الحوامض القوية معروف لدى الجميع إلا أن القيمة الحقيقية للرقم الهيدروجيني للمياه أو السوائل التي تكون في تماس مع الهياكل المعدنية أو الأنابيب أو الأجهزة لا تأخذ بعين الاعتبار بشكل ملموس إن تأكل الحديد الخالية من الأكسجين يكون قليلاً حتى ينخفض الرقم الهيدروجيني للماء إلى أقل من خمسة كما موضح في الشكل التالي:
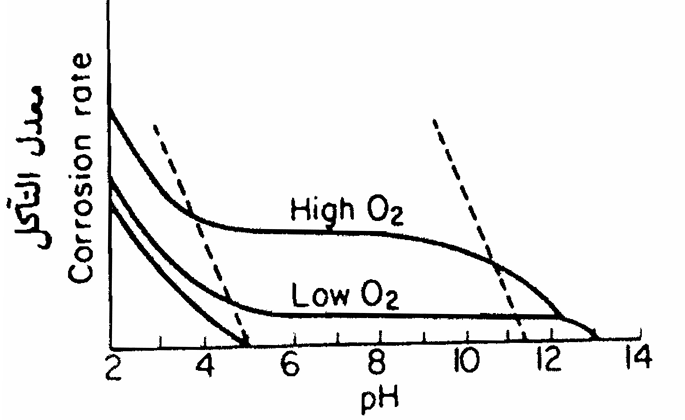
رقم الهيدروجين (pH)
تأثير رقم الهيدروجين وتركيز الأكسجين على تآكل الحديد إن سرعة التآكل عند وجود الأكسجين تكون أكبر بكثير مقارنة مع عدم وجوده يتميز التآكل بسرعة ثابتة عملياً عند رقم هيدروجيني يتراوح من 4 أو 5 إلى 10 أون 12 وأن القيمة الحقيقية تعتمد على تركيز الأكسجين عند الرقم الهيدروجيني الذي يساوى 4 يتزايد معدل التآكل نتيجة تحول أيونات الحديدوز إلى الحديديك
Fe++→ Fe+++ بواسطة الأكسجين المذاب ثم الاختزال لأيونات الحديديك عند القطب السالب في المحاليل التي تتميز برقم هيدروجيني أعلى فإن الزيادة في مجموعة الهيدروكسيل -(OH) المتواجدة مع أيونات الحديـــدوز (++Fe) تكون هيدروكسيد الحديدوز 2(Fe (OH) والذي هو راسب جيلاتيني يتأكسد ببطء إلى (FeO (OH أو الصدأ. عند الأرقام الهيدروجينية العالية يتكون هيدروكسيد الحديدوز حال ظهور أيونات الحديدوز عند القطب الموجب مما يعيق الوصول إلى القطب الموجب فيؤدي إلى تقليل سرعة التآكل. يتأكل الخارصين بصورة سريعة حتى فى الأحماض الضعيفة، مثل حامض الكربونيك، المواد العضوية المخمرة تؤدي إلى نزع الخارصين من الأوعية المجلفنة (Galvanized) وأن الحد الأدنى لتأكل الخارصين يحدث عند رقم هيدروجيني يساوي 1 في المحاليل الأكثر قلوية يذوب المعدن والقصدير يتآكل بسرعة عند رقم هيدروجيني أكبر من 8.5 الالمنيوم والرصاص يذوبان في المحيطات القلوية والالمنيوم يتميز بحد أدني للتآكل عند رقم هيدروجيني يساوي تقريباً 5.5. لقد شوهد تأكل أنابيب الالمنيوم المستخدمة لتهوية مجففات الغسيل الأتوماتيكية المثبتة فى حوائط من السمنت وأن أنابيب الرصاص أو الأسلاك المغطاة بالرصاص يجب عدم وضعها في مناطق يكثر فيها الرماد لأن رقمها الهيدروجيني أعلى من الأرض المجاورة وأن الرصاص يذوب أو يتآكل في المحيط القلوي إن المياه الآتية من المناجم ومعظم الفضلات الصناعية هي حامضية فالمجاري في مناجم الفحم المتروكة تحوي على كبريت وحامض الكبريتيك وهي مواد تعجل في تأكل الجسور والقوارب والسدود والأنابيب أن الحامض يتكون من الأكسدة الرطبة لكبريتيد الحديد الأبيض (Marcasite) وهذا التفاعل يحدث كما مبين في المعادلة التالية:
3FeS2+11O2+4H2O→2Fe (OH)SO4 + FeSO4 + 3H2SO4 وعليه يجب استخدام المضخات والأنابيب التي تقاوم التأكل الحامضي في معظم المناجم.