علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الخاصية الأروماتية
المؤلف:
د. محمد بن إبراهيم الحسن – د. حسن بن محمد الحازمي
المصدر:
أسس الكيمياء العضوية
الجزء والصفحة:
ص127-125
2025-01-08
360
هناك خواص جامعة لكل من المركبات الأروماتية وهي كما يلـ يلي: - أن يحتوي المركب الأروماتي على شكل حلقي يحتوي على سحابة في مسار دائري من الكترونات باى اللاموضعية فوق وتحت مستوى الحلقة ناتجة عن تداخل بين الالكترونات الموجودة في مداراتp المتجاورة. بمعنى آخر لكي نحصل على سحابة الكترونية في مسار دائري يجب أن لا تكون الذرات في الحلقة مفصولة بذرة كربون مشبعة.
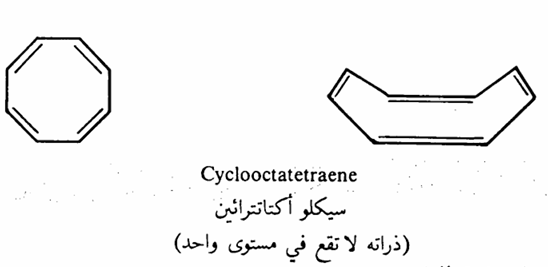
- لكي يحصل أقصى تداخل بين مدارات P يجب أن تقع ذرات المركب الأروماتي على مستوى واحد.
- تؤدى هذه السحابة من الكترونات باى اللاموضعية إلى ثبات الحلقة الأروماتية وبالتالي فإن الحلقة ذات الصفة الأروماتية تخضع لتفاعلات الاستبدال بدلاً من تفاعلات الإضافة التي بدورها تؤدي إلى تخريب الصفة الأروماتية.يجب أن تحتوي السحابة الالكترونية على مجموع (2 + 4n) الكترونات باي حيث= n 0,1,2,3,4.....الخ , أي أنه يجب أن تحتوي على أعداد خاصة من هذه الالكترونات مثل 2، 6 ,10وهكذا حتى يكون المركب أروماتيا، وتسمى هذه القاعدة بقاعدة هوكل Huckel نسبة إلى مكتشفها وهي تعتمد على ميكانيكا الكم , ففي حالة جزىء البنزين مثلاً نعتبر n يساوى واحد وبالتالي يصبح القانون 6 = 2 + (4n) وهذا ينطبق على عدد الكترونات باي في حلقة البنزين حيث أنه يوجد ستة الكترونات باى ويمكن تطبيق هذه القاعدة على المركبات الأروماتية التي تشمل أكثر من حلقة بنزين كالنفثالين (عشرة الكترونات باى والانثراسين (أربعة عشر الكترون باى). وكذلك فإن المركبات غير المتجانسة مثل البيرول والأندول وغيرها تعتبر أروماتية مثلها مثل البنزين في خواصه. كما أن قاعدة هوكل تنطبق عليه حيث أن البيرول مثلاً يحتوى على سته الكترونات باى أربعة منها على مدارات 2p لذرات الكربون الأربع واثنان على مدار 2p للذرة غير المتجانسة.

من جهة أخرى نجد أن مركب السيكلــــــو أو كتانتراثين cyclooctatetraene الذي يحتوى على ثمانية الكترونات باى يعتبر مركباً غير أروماتي لأن قاعدة هوكل لا تنطبق عليه حيث أنه لا يوجد عدد صحيح يمكن تعويضه على الرمز n لكي نحصل على العدد ثمانية طبقاً للقاعدة 2 + 4n. لذلك نجد أن جزىء السيكلو أو كتانتراثين يتفاعل مع البروم وبرمنجنات البوتاسيوم بالإضافة كما في حالة الأوليفينات. وقد بينت الأشعة السينية أن ذراته لا تقع على مستوى واحد وكما نعرف أنه شرط أساسي للمركبات الأروماتية أن تقع ذراتها على مستوى واحد