

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تركيب جزىء الايثان
المؤلف:
د. محمد بن إبراهيم الحسن – د. حسن بن محمد الحازمي
المصدر:
أسس الكيمياء العضوية
الجزء والصفحة:
ص 53-57
2025-01-06
420
درسنا كيفية تركيب جزىء الميثان وأنه يأخذ شكل رباعي السطوح (هرم رباعي) تقع ذرات الهيدروجين على أركانه. كما أن زوايا الروابط متساوية وتساوي زاوية رباعي السطوح أي 109٫5 وأن أطوال الروابط بين ذرة الكربون وذرة الهيدروجين متساوية إذ يبلغ طول الرابطة 1,09 أنجستروم.
في الألكانات العليا (الأعلى من (الميثان عندما تستبدل ذرة هيدروجين أو أكثر بذرة كربون فإن طريقة الارتباط السابق الهرم (الرباعي) تكون متشابهة حيث
يبقى هرماً رباعياً لا تختلف أبعاده وزواياه عما هي في جزىء الميثان. فمثلاً الايثان كل ذرة كربون فيه مرتبطة بثلاث ذرات هيدروجين وذرة كربون أخرى. وكما
في حالة الميثان الروابط بين الكربون والهيدروجين تنتج من تداخل مدارات (sp3) للكربون ومدارات (s) لذرات الهيدروجين. أما الرابطة بين الكربون والكربون فتنتج من تداخل مداراي sp3 لذرتي الكربون. وبذلك يتخذ جزىء الايثان شكل هرمين يلتقيان برأس كل منهما يطلق على الرابطة بين الكربون والهيدروجين والرابطة بين الكربون والكربون اسم رابطة سيجما (يرمز لها بـ ) وهي أبسط الروابط الكيميائية وهي اسطوانية متماثلة حول محور الارتباط بين الذرتين وهكذا بالنسبة للألكانات الأخرى.
) وهي أبسط الروابط الكيميائية وهي اسطوانية متماثلة حول محور الارتباط بين الذرتين وهكذا بالنسبة للألكانات الأخرى.
وتبين الأشكال (2 - 1 ، 2- 2) تركيب جزىء الايثان.
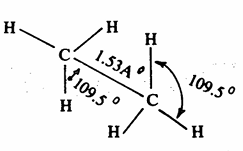
شکل 2– 1: شكل وحجم جزىء الايثان
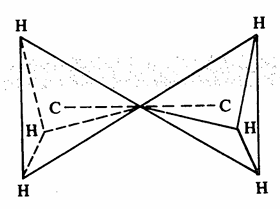
شكل 2- 2جزىء الايثان على شكل هرمين يلتقيان برأس كل منهما
الهيئة الفراغية للألكانات Conformation of Alkanes (الدوران الحر حول الرابطة الأحادية بين الكربون - والكربون)
تتميز الذرات التي ترتبط برابطة أحادية بقدرتها على الدوران حول الرابطة الأحادية. وبالتالي يتخذ الجزىء أشكالاً مختلفة بسبب تلك الظاهرة، وسندرس كلا من جزىء الايثان وجزىء البيوتان لتوضيح هذه الفكرة. يمكن أن يتخذ جزىء الايثان والبيوتان عدة أوضاع فراغية نتيجة للدوران الحر حول الرابطة الأحادية بين ذرتي الكربون، وبإمكاننا تحديد وضعين الجزىء الايثان وثلاثة أوضاع الجزيء. البيوتان. وتجدر الإشارة هنا أنه لا يمكن فصل هذه الأوضاع عن بعضها البعض لأنها تحتاج إلى جزء بسيط من الطاقة للتحول من وضع لآخر أي أنها. حالة في دوران مستمر ولهذا) فإنها لا تشكل متشابهات متماكبات. فمثلا في جزىء الايثان يمكن تحديد وضعين متميزين هما الوضع المتعاقب staggered conformation والوضع الظلي eclipsed conformation. ويمكن توضيح هذين الوضعين بعدة طرق أهمها طريقة ساو هورس Sawhorse أو طريقة نيومان Newman (ينظر إلى الجزىء من الأمام بحيث نتصور إحدى ذرات الكربون وتختفي ذرة الكربون الأخرى خلف ذرة الكربون الأمامية)، أو طريقة الخطوط المنقطة (حيث تبين ذرات الهيدروجين الخلفية على شكل نقاط والأمامية على شكل خطوط عريضة، وذرات الهيدروجين التي تقع على مستوى الصفحة على شكل خطوط عادية . تذكر أن الجزىء يأخذ شكل هرم رباعي أى أن ذراته لا تقع على مستوى واحد).
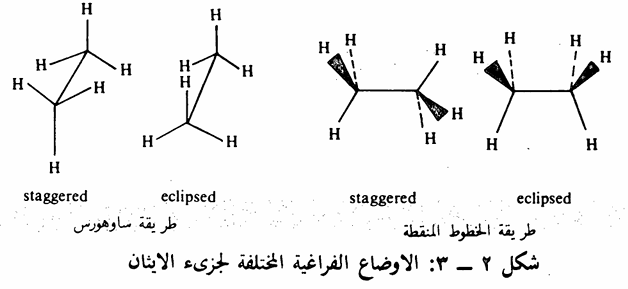

يتضح من الشكل (2) - (3) أن الوضع الظلي أقل استقراراً (أغنى طاقة) من الوضع المتعاقب وذلك للتنافر بين ذرات الهيدروجين (الفعل الفراغي بين الذرات أو التنافر الناتج من الالكترونات المحيطة بتلك الذرات) ويتضح ذلك بصورة أكثر عندما نستبدل ذرة الهيدروجين الصغيرة بمجموعة أكبر منها مثل مجموعة الميثل كما في جزيء البروبان. وقد بينت الدراسات أن فارق الطاقة بين الوضع الظلي والوضع المتعاقب في جزيء الايثان هو 3 كيلو سعر /مول بينما تزيد تلك الطاقة في جزيء البروبان إلى 3,3 كيلو سعر / مول. وتصل تلك الطاقة إلى 3٫89 كيلو سعر /مول في جزيء البيوتان النظامي حيث تستبدل ذرتا هيدروجين بمجموعتي ميثل (شكل 2 - 4).
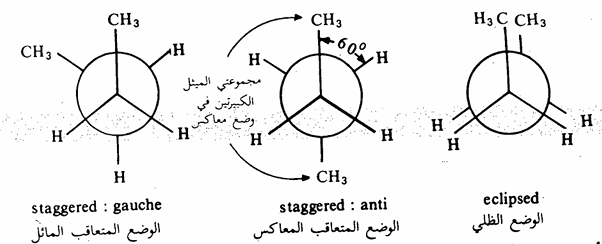
شكل 2 - 4: طريقة نيومان لتوضيح الأوضاع الفراغية المختلفة لجزيء البيوتان
وتجدر الإشارة إلى أن الفرق بين طاقتي الوضعين المستقرين المعاكس Anti والمائل Gauche يجعل نسبة وجودهما 80٪ من الزمن للوضع المعاكس anti، ٪20 من الزمن يأخذه الوضع المائل Gauche (10%) عندما تكون مجموعة CH3 نحو اليمين، 10٪ عندما تكون مجموعة H, نحو اليسار بالنسبة لمجموعة الميثل المثبتة، حيث أنه عند دوران الجزىء، نفترض دوران إحدى مجموعتي الميثل مع ثبات الأخرى).