

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تحدد تغيرات الطاقة الحرة (Free energy) اتجاه التفاعل الكيميائي وحالة توازنه (Equilibrium state)
المؤلف:
د. روبرت موراي وآخرون
المصدر:
هاربرز في الكيمياء الحيوية
الجزء والصفحة:
ص 252
6-6-2021
3161
تحدد تغيرات الطاقة الحرة (Free energy) اتجاه التفاعل الكيميائي وحالة توازنه (Equilibrium state)
التفاعلات الكيميائية عكسية (Reversible) بطبيعتها، فإذا كان من الممكن أن يتفاعل جزيء من المادة A مع أخر من المادة B ليشكلا أنواعا أخرى من الجزيئات الكيميائية ( P و Q) كما يلي:
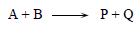
فإن التفاعل العكسي ممكن أيضاً:

نميل عادة لتمثيل التفاعلات الكيميائية بالشكل المكتوب أعلاه (وكأنها (غير عكسية») عندما تدعم العوامل الثرموديتاميكية (Thermodynamic) التي تقود هذه التفاعلات بقوة تشكل النواتج (أي المركبات التي يشير إليها السهم الأول). ضمن هذه الظروف، ستتحول كل المواد المتفاعلة إلى المنتجات عند تمام التفاعل. وفي حين يبقى العكس سكنا، إلا أنه يحدث بمعدل صغير جدا لدرجة يعكن أن تهمل معها مساهمته في مجمل التفاعل. ومع ذلك، تحتفظ مساهمة عكس التفاعل في العديد من التفاعلات (ومن بينها تفاعلات تحدث في الخلية الحية) بأهمية بالغة يجب أخذها بعين الاعتبار. ويمكن الاستدلال على ذلك بكتابة التفاعل ورسم سهم مضاعف بالاتجاهين:

إن التغير في الطاقة الحرة ("free energy “AG) هو القوة الثرموديناميكية الموجهة التبي حدد الاتجاه الذي يتقدم التفاعل نجوه وتراكيز المتفاعلات والنواتج عند شام التفاعل، أي عند الوصول إلى حالة التوازن (Equilibrium state) ويمثل التغير في الطاقة الحرة (غالبا ما يسمى الطاقة الحرة للتبسيط) الفرق بين مجموع الطاقات الحرة للمركبات الكيميائية على ببين السهم (أي المنتجات) ومجموع الطاقات الحرة للمركبات الكمميائية على يسار السهم (أي المتفاعلات أو الركائز). وعندما تقاس الطاقة الحرة في الشروط القياسية (Standard) (الفصل 12) فإنها تعطى الرمز AG٥. فإذا كانت الطاقة الحرة لنواتج التفاعل أخفض من تلك الخاصة بالمتفاعلات، فإن قيمة AG٥. ستكون سلبية وسيميل التفاعل للتقدم كما هو مكتوب (أي من اليسار إلى اليمين). أما إلى أي حد سيبقى فيه التفاعل في هذا الاتجاه قبل بلوغ حالة التوازن فهو ما تحدده إشارة تغير الطاقة الحرة ومقدارها. ويرتبط تغير الطاقة الحرة بثابتة التوازن (”Equilibrium constant "keq) لتفاعل ما بالعلاقة التالية:
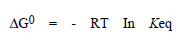
حيث أن R وهي ثابتة الغاز، أما T فهي درجة احرارة المطلقة.
عند الاتزان وبالتطبيق على التفاعل المذكور أعلاه، نجد ثابت التوازن Keq:
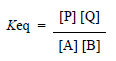
تسمح هذه العلاقات لنا بحساب قيمة AG0 من خلال قياس التراكيز النسبية للمتفاعلات والنواتج بعد بلوغ التوازن؛ فإذا كانت سلبية، فإن ثابتة التوازن ستكون أكبر من القيمة 1، دالة على أن تركيز المنتجات أكبر من تركيز المتفاعلات في حالة التوازن. أم القيمة الإيجابية للـ AG0 فتعني أن ثابتة التوازن ستكون أقل من 1 وأن التفاعل سيسير باتجاه تراكم المتفاعلات.
لاحظ أنه بينما تدلنا قيم كل من AG0و Keq إلى الاتجاه العفوي أو التلقائي (Spontaneous) للتفاعل، فهي لا تعطينا أية معلومات عن سرعة التفاعل. ذلك لأن تلقائي الطاقة الحرة للتفاعل الإجمالي تتعلق بالحالة الأولية والنهائية للأنواع المتفاعلة فقط. ولذلك، يكون AG0 مستقلا عن ألية التفاعلات ولا يعطي أية معلومات حول معدلاتها. وبكلمات أخرى، يمكن أن يكون للتفاعل AG0 تؤيد حدوثه بقوة لكنه يحدث بمعدل بطيء.