
تحدد المجموعة R خصائص كل حمض أميني
 المؤلف:
د. روبرت موراي وآخرون
المؤلف:
د. روبرت موراي وآخرون
 المصدر:
هاربرز في الكيمياء الحيوية
المصدر:
هاربرز في الكيمياء الحيوية
 الجزء والصفحة:
ص 93
الجزء والصفحة:
ص 93
 4-4-2021
4-4-2021
 4968
4968
تحدد المجموعة R خصائص كل حمض أميني
يمكن للجليسين بوصفه أصغر حمض أميني أن يوجد فى مناطق من البنية ثلاثية الأبعاد للبروتين لا يستطيع غيره من الأحماض البوصول إليها ، ولذلك فهو يوجد عادة في مناطق الانثناء الحاد للبروتين.
كما هو واضح في (الجدول 4-3) ، فإن الزمر الأليفاتية R في كل من الألانين والفالين واللوسين والإيزولوسين والحلقية في كل من الفينيل الانين والتيروزين والتويبتوفان كلها كارهة للماء (Hydrophobic) ولأن ذوبان هذه الأحماض الأمينية سيحضر الماء إلى محيطها ، فموقعها النموذجي هو في باطن بروتينات العصارة الخلوية (Cytosolic proteins).

أما الزمر المشحونة الموجودة في الأحماض الأمينية الحمضية والقاعدية فتعمل على استقرار هيئات (Conformations) بروتينية معينة عن طريق التأثرات الأيونية أو الرواد الملحية؛ فعلى سبيل المثال ، تترافق أكسجة (Oxygenation) الهيموجلوبين ونزع الأكسجين منه (Oxygenation) مع تمزق الروابط الملحية وإعادة تشكيلها (انظر الفصل السابع) . وبالإضافة لذلك ، توظف الزمر R المشحونة سلبا أو إيجاباً في أنظمة (( الترحيل التتابعي للشحنة )) (Charge relay) التي تنقل الشحنات عبر مسافات كبيرة خلال التحفيز الإنزيمي وخلال نقل الإلكترونات في السلسلة التنفسية في المتقدرات. وأخيراً ، يلعب الهيستيدين أدوارا خاصة ومميزة في التحفيز الإنزيمي حيث تسمح قيمة pK بروتون الإيميدازول بأن يعمل الهيستيدين كمحفز (Catalyst) حمضي أو قاعدي في درجة باهاء (7.0 = (pH.
وننتقل إلى زمر أخرى كالزمرة الكحولية الأولية في السيرين والزمرة الكحولية الكبريتية الأولية (SH-) في السيستيين. كلاهما أليفتان للنوى (Nucleophiles) ويمكن أن تعملا على حالتهما هذه خلال عملية التحفيز الإنزيمي. وبالمقابل ، ورغم كونها أليفة للنوى أيضاً ، فإنه غير معروف عن زمرة الكحول الثانوية للتيروزين أنها تلعب هذا الدور خلال عملية التحفيز الإنزيمي. ونضيف هنا الدور الذي يلعبه كل من السيرين والتيروزين والثريونين في تنظيم نشاط إنزيمات معينة يتعلق نشاطها التحفيزي بفسفتة بعض ثمالات (Residues) الأمينوأسيل الهيدووكسيلية ونزع الفسفات منها .
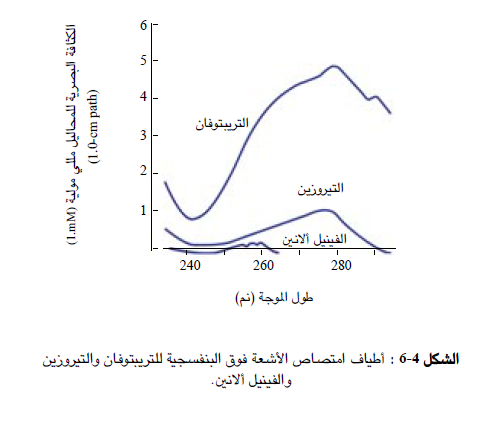
وفيما يتعلق ببعض الخصائص الفيزيائية نذكر هنا أن الأحماض الأمينية لا تمتص الضوء المرئي ( ولذا فهي عديدة اللون) ، وأنها لا تمتص الأشعة فوق البنفسجية ذات الموجات التي يزيد طولها عن 240 نانومتر ، ويستثنى من ذلك الأحماض الأمينية الأروماتية : التريبتوفان والفينيل الانين والتيروزين والهيستيدين التي تمتص ، وخاصة الحمض الأول ، الأشعة فوق البنفسجية ذات الموجات الطويلة ( من 250 إلى 290 نانومتر) ( الشكل 4-(6 . وعلى الرغم من عدم شيوعه نسبيا في معظم البروتينات ، فإن التريبتوفان هو المسؤول الأكبر عن قابلية معظم البروتينات لامتصاص الضوء عند الموجة ذات الطول 240 نانومتر.
 الاكثر قراءة في الاحماض الامينية والبروتينات
الاكثر قراءة في الاحماض الامينية والبروتينات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


